重磅科普|英国脱欧在即,速查医疗器械准入新规,看看如何申请UKCA
英国已于2020年1月正式脱欧,且过渡期将于今年年底(2020年12月31日)结束。自2021年1月1日起,医疗器械进入英国市场将有新的要求。
除了众所周知的UKCA通用的要求外,医疗器械进入英国市场有其特定的规则。在此,这里统一做一个详细的解读。
UKCA是什么?
UKCA(英国合格评定)是新的英国产品符合性标识,将用于过渡期后投放英国市场(英格兰、威尔士以及苏格兰,但不包括北爱尔兰)的某些产品,包括医疗器械。
UKCA标识不会在欧盟、欧洲经济区或北爱尔兰市场得到认可,当前需CE标识的产品销往这些市场仍需CE标识。
从2021年1月1日起,销往英国市场的制造商将可使用UKCA标识,所有产品必须满足的技术要求以及可用于证明合格性的合格评定过程和标准将与现行的基本相同。
进入英国市场(不包含北爱尔兰)流程图:
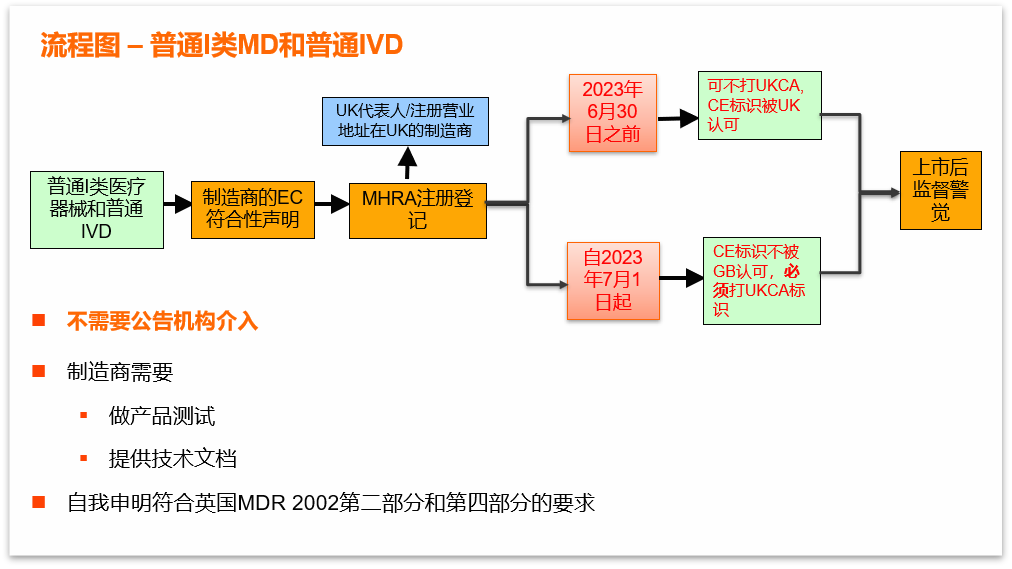
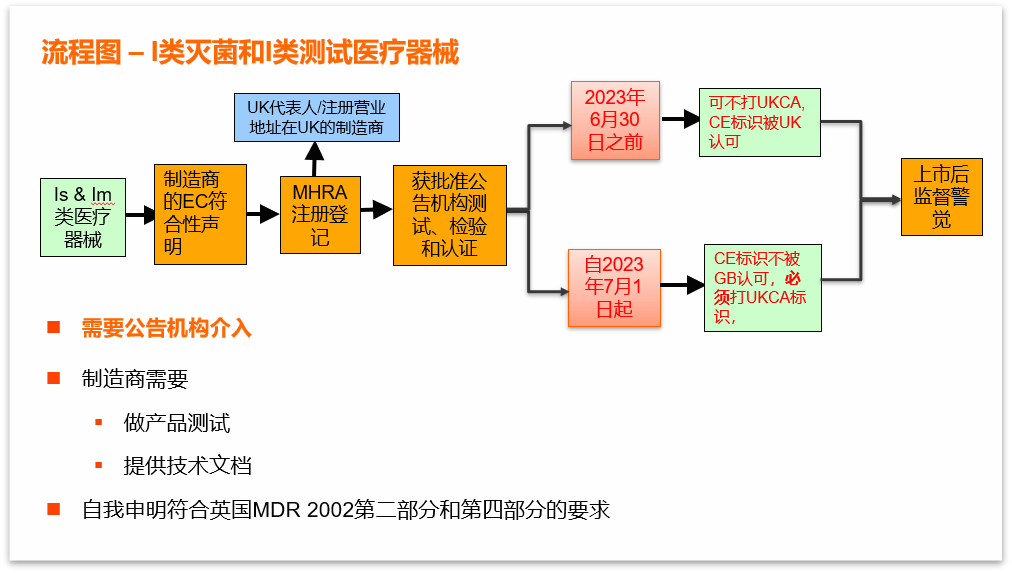
1.MHRA注册:

2.UKCA标识:
自2023年7月1日起,医疗设备投放英国市场(不包括北爱尔兰)需满足在设备上打UKCA标识这一要求。此要求不适用于北爱尔兰市场。
3.CE 标识:
直至2023年6月30日, MHRA将继续认可设备的CE标志,这将适用于英国市场上根据以下适用的欧盟法规进行CE标记并完全符合以下规定的设备:
Directive 90/385/EEC 有源植入式医疗器械(EU AIMDD)
Directive 93/42/EEC 医疗器械 (EU MDD)
Directive 98/79/EC 体外诊断医疗器械 (EU IVDD)
Regulation 2017/745 医疗器械 (EU MDR)
Regulation 2017/746 体外诊断医疗器械(EU IVDR)
4.标签要求:
2021年1月1日起,投放英国市场的医疗器械需有UKCA或CE标识;
在特定情况下,需在标签上显示公告机构或批准机构的编号;
2023年7月1日前,英国市场接受CE标识的设备;2023年7月1日后,英国市场接受CE
+UKCA标志的设备或者UKCA标志设备。
5.北爱尔兰医疗器械法规——MDR/IVDR“欧盟框架下”:
